- CÉSIUM
- CÉSIUMLe césium est l’élément chimique de numéro atomique 55 et de symbole Cs; il a été identifié pour la première fois en 1860 par Kirchhoff et Bunsen par analyse spectrale; deux raies bleues à 456 et 459,7 nm sont à l’origine de son nom (caesium : bleu du ciel). C’est un métal jaune pâle très facilement fusible.Si l’on excepte le francium, élément 87 qui ne possède pas d’isotope stable, le césium apparaît comme le dernier élément de la famille des métaux alcalins. Sa structure électronique fondamentale est caractérisée par un électron célibataire 6 s qui fait suite à une structure de gaz rare en s 2p 6 (xénon). De l’effet d’écran dû à cette configuration électronique particulière, il résulte que l’électron de valence n’est que faiblement lié et que cette propriété fondamentale des métaux alcalins est particulièrement marquée dans le cas du césium comme l’indique son faible potentiel d’ionisation: 3,90 e V.Le césium, comme tous les métaux alcalins, possède dans ses combinaisons le degré d’oxydation + 1, et n’échange que des liaisons ioniques. C’est le plus électropositif de tous les métaux (EOH Cs/Cs+ = 漣 3,02 V).État naturel et préparationLe césium n’entre que pour un très faible pourcentage dans la composition de l’écorce terrestre (0,0007 p. 100). Il accompagne généralement, en très petite quantité, les autres alcalins dans leurs minerais (lépidolite). Il existe toutefois aux États-Unis, et en Suède un minerai très riche, appelé pollux ou pollucite, silicoaluminate de césium titrant jusqu’à 36 p. 100 en Cs2O et ne contenant que des traces de potassium et de rubidium.L’extraction du césium à partir d’un minerai complexe (lépidolite), contenant les autres alcalins, constitue l’une des préparations les plus longues et les plus délicates de la chimie minérale (tabl. 1). La séparation est effectuée par cristallisation fractionnée de sels dont la solubilité diminue fortement du sodium au césium: aluns (Al2(SO4)3, M2S4, 24H2O) puis chlorures complexes (M3Sb2Cl9 ou M2PtCl2).Le chlorure CsCl constitue le produit commercial le plus courant et le plus pur; il est facilement réduit par le calcium en césium métallique, en opérant sous vide vers 700 0C. Le césium est purifié par distillation fractionnée sous vide moléculaire et conservé en ampoule scellée.PropriétésLes principales constantes physiques sont indiquées au tableau 2.Le césium cristallise dans le système cubique centré. C’est de tous les métaux celui qui possède le rayon atomique le plus élevé et la dureté la plus faible. La vapeur de césium est essentiellement monoatomique.Le césium possède les propriétés chimiques caractéristiques des éléments de la famille des alcalins. Il est extrêmement réactif, se combinant avec les éléments électronégatifs pour donner des composés typiquement ioniques, solubles dans l’eau et qui constituent des électrolytes forts.Le césium se combine avec l’hydrogène pour donner un hydrure salin CsH, de structure analogue à celle du chlorure de sodium, dans lequel l’hydrogène se trouve sous forme d’ion H-. Peu stable, CsH se décompose avant fusion.Le césium brûle en présence d’un halogène. En raison de la taille de l’ion Cs+, les variétés usuelles d’halogénures ne possèdent pas la structure NaCl correspondant à la coordination 6; elles cristallisent avec une maille cubique centrée, l’ion Cs+ situé au centre se trouvant entouré par huit ions X- (X = Cl, Br, I) situés aux sommets. Ces halogénures forment entre eux ou avec d’autres halogénures métalliques des complexes colorés bien cristallisés et généralement peu solubles (Cs(Cl2I) ou Cs2PtCl6, par exemple).La réactivité de l’oxygène vis-à-vis des métaux alcalins augmentant avec le numéro atomique, le césium est de tous les métaux celui qui présente la plus grande oxydabilité. Mis en contact avec l’air, le métal s’enflamme instantanément en donnant surtout un peroxyde Cs2 correspondant à l’ion -2, contrairement au sodium et au lithium dont la combustion conduit à des oxydes correspondant respectivement aux ions 2-2 et 2-. Cette différence de comportement est liée à la diminution du potentiel d’ionisation avec le rayon ionique.Le système césium-oxygène est complexe; il comporte, en plus de l’oxyde normal Cs2O, des sous-oxydes et des peroxydes. Tous les oxydes de césium, contrairement aux autres oxydes alcalins, sont fortement colorés, certains sont noirs (tabl. 3). L’action de l’eau sur les oxydes conduit à l’hydroxyde CsOH, nommé parfois césine ; c’est une base forte.Le césium brûle dans la vapeur de soufre en donnant un monosulfure Cs2S et une série de polysulfures Cs2Cn avec n = 2,3,4,5,6. Ces composés de couleur jaune ou rouge, solubles dans l’eau, sont constitués de chaînes d’atomes de soufre terminées par deux atomes métalliques. Les valeurs élevées de n dans le cas du césium – alors que n dans le cas du lithium prend les valeurs 2 et 4 – s’expliquent également par la taille du cation Cs+.Le césium se dissout très facilement dans l’ammoniac liquide en donnant une solution bleue. La présence d’ions césium et d’électrons solvatés:
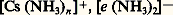 explique la conductivité électrique élevée de cette solution. Le césium réagit avec l’ammoniac gazeux avec formation d’un amidure CsNH2 très soluble dans l’ammoniac liquide.Le césium se combine avec l’acétylène pour donner les deux carbures Cs 漣 C 令 C 漣 H et Cs 漣 C 令 C 漣 Cs; ces composés ioniques incolores sont très réactifs et facilement hydrolysables. Quelques composés organométalliques du césium ont été signalés.Le césium liquide réagit vivement avec le graphite en donnant une famille de composés lamellaires d’insertion, à caractère métallique, dont le plus riche, de couleur jaune, correspond à la formule structurale C8Cs.ApplicationsEn dehors de quelques applications en chimie analytique (complexes colorés), les principaux usages du césium découlent de sa très grande sensibilité à l’oxydation (getter dans les tubes électroniques) et surtout de son faible potentiel d’ionisation. Cette dernière propriété fait utiliser ce métal: pour la fabrication de cathodes photo- ou thermo-émissives; en magnétohydrodynamique ou dans les projets de moteurs à ions; pour neutraliser la charge d’espace dans les convertisseurs d’énergie.
explique la conductivité électrique élevée de cette solution. Le césium réagit avec l’ammoniac gazeux avec formation d’un amidure CsNH2 très soluble dans l’ammoniac liquide.Le césium se combine avec l’acétylène pour donner les deux carbures Cs 漣 C 令 C 漣 H et Cs 漣 C 令 C 漣 Cs; ces composés ioniques incolores sont très réactifs et facilement hydrolysables. Quelques composés organométalliques du césium ont été signalés.Le césium liquide réagit vivement avec le graphite en donnant une famille de composés lamellaires d’insertion, à caractère métallique, dont le plus riche, de couleur jaune, correspond à la formule structurale C8Cs.ApplicationsEn dehors de quelques applications en chimie analytique (complexes colorés), les principaux usages du césium découlent de sa très grande sensibilité à l’oxydation (getter dans les tubes électroniques) et surtout de son faible potentiel d’ionisation. Cette dernière propriété fait utiliser ce métal: pour la fabrication de cathodes photo- ou thermo-émissives; en magnétohydrodynamique ou dans les projets de moteurs à ions; pour neutraliser la charge d’espace dans les convertisseurs d’énergie.
césium [ sezjɔm ] n. m.• 1866; lat. cæsium, neutre de cæsius « bleu », à cause de ses raies spectrales♦ Chim. Élément atomique (Cs; no at. 55; m. at. 132,90) du groupe des alcalins, métal mou, jaune. Chlorure de césium. Horloge atomique au césium. Cellule photoélectrique au césium.césiumn. m. CHIM élément alcalin (symbole Cs) de numéro atomique Z = 55.— Métal qui entre dans la fabrication de cathodes photoémissives et de tubes électroniques.⇒CÉSIUM, subst. masc.CHIM. Corps simple métallique (Cs), alcalin, chimiquement voisin du potassium, très rare, susceptible d'applications intéressantes en raison de sa grande sensibilité d'oxydation et de son faible potentiel d'ionisation. Tube à césium (B. DECAUX, La Mesure précise du temps, 1959, p. 101). Raie spectrale du césium (B. DECAUX, La Mesure précise du temps, 1959 p. 19).Prononc. et Orth. :[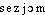 ]. Fait partie, sous la forme caesium, d',,une catégorie spéciale de mots latins ou grecs [...] où l'on retrouve encore, sans raison particulière, les fausses diphtongues æ et œ, si gênantes à l'écriture comme à la lecture. Il y en a très peu, et elles pourraient être supprimées, sans que personne s'en aperçoive, en faveur du é accentué`` (N. CATACH, J. GOLFAND, R. DENUX, Orth. et lexicogr., Paris, Didier, t. 1, 1971, p. 95); ces aut. proposent, en conséquence, césium ou césion. Étymol. et Hist. [Premier métal découvert, grâce à l'analyse spectrale, par Kirchhoff et Bunsen en 1860]; 1866 caesium, césium (Lar. 19e). Terme créé par les deux savants all. R. W. Bunsen [1811-99] et G. R. Kirchhoff [1824-87] (Brockhaus) à partir du lat. caesius « bleu » (en raison de la double ligne bleue qui apparaît dans l'analyse spectrale) sur le modèle des noms de métal en -ium, v. Brockhaus, s.v. Cäsium, Zäsium.césium [sezjɔm] n. m.ÉTYM. 1861, mot créé en all. par Bunsen et Kirchhoff; lat. cæsium, neutre de cæsius « bleu », à cause des deux raies bleues de son spectre.❖♦ Chim. Métal (symb. Cs; no at. 55; masse at. env. 133) de la famille des alcalins, mou, jaune pâle. || Cellule photo-électrique au césium. — REM. On a écrit cæsium.
]. Fait partie, sous la forme caesium, d',,une catégorie spéciale de mots latins ou grecs [...] où l'on retrouve encore, sans raison particulière, les fausses diphtongues æ et œ, si gênantes à l'écriture comme à la lecture. Il y en a très peu, et elles pourraient être supprimées, sans que personne s'en aperçoive, en faveur du é accentué`` (N. CATACH, J. GOLFAND, R. DENUX, Orth. et lexicogr., Paris, Didier, t. 1, 1971, p. 95); ces aut. proposent, en conséquence, césium ou césion. Étymol. et Hist. [Premier métal découvert, grâce à l'analyse spectrale, par Kirchhoff et Bunsen en 1860]; 1866 caesium, césium (Lar. 19e). Terme créé par les deux savants all. R. W. Bunsen [1811-99] et G. R. Kirchhoff [1824-87] (Brockhaus) à partir du lat. caesius « bleu » (en raison de la double ligne bleue qui apparaît dans l'analyse spectrale) sur le modèle des noms de métal en -ium, v. Brockhaus, s.v. Cäsium, Zäsium.césium [sezjɔm] n. m.ÉTYM. 1861, mot créé en all. par Bunsen et Kirchhoff; lat. cæsium, neutre de cæsius « bleu », à cause des deux raies bleues de son spectre.❖♦ Chim. Métal (symb. Cs; no at. 55; masse at. env. 133) de la famille des alcalins, mou, jaune pâle. || Cellule photo-électrique au césium. — REM. On a écrit cæsium.
Encyclopédie Universelle. 2012.
